10.3 Chemische Bindungen
In Bild 10.19 siehst du Stücke von Natrium, einem weichen Metall.
Aber warum bilden Atome eigentlich feste Körper? Warum leiten Metalle elektrischen Strom? Warum lassen sich einige Stoffe mit einem Messer teilen und andere zerbrechen nur bei dem Versuch, sie zu schneiden? Und was ist so besonderes an Kohlenstoff, dass er einen eigenen Zweig der Chemie hervorgebracht hat? Antworten auf diese Fragen findest du in diesem Kapitel, in dem wir uns mit chemischen Bindungen beschäftigen.
10.3.1 Edelgaszustand
Im Abschnitt über das Periodensystem hast du die Gruppe der Edelgase kurz kennengelernt. Ihnen gemeinsam ist die Eigenschaft, dass sie keine Verbindungen mit anderen Atomen eingehen.
Betrachtest du ihre Elektronenhülle, kannst du feststellen, dass alle Edelgase acht Elektronen in der äußersten Schale besitzen (Edelgaskonfiguration). Offensichtlich entspricht diese Konfiguration einem extrem günstigen Energiezustand. Wie stabil dieser Zustand ist, kannst du an der Ionisierungsenergie – die notwendige Energie, um ein Elektron von einem Atom zu trennen – erkennen (Bild 10.20). Sie ist für Edelgase besonders hoch.
Auch die Atome aller anderen Elemente streben nach diesem Zustand von acht Elektronen in der äußersten Schale. Sie erreichen diesen Edelgaszustand, in dem sie Elektronen aus der äußersten Schale aufnehmen, abgeben oder gemeinsam verwenden. Atome können so zwar den Edelgaszustand erreichen, aber natürlich nicht selbst zu einem Edelgas werden. Dazu müsste der Atomkern verändert werden – und das geht mit chemischen Mitteln nicht.
Da die äußerste Elektronenschale eine ganz besondere Rolle bei chemischen Bindungen spielt, hat sie einen eigenen Namen. Sie wird Valenzschale (engl. valence shell) genannt und die darin befindlichen Elektronen werden als Valenzelektronen (engl. valence electrons) bezeichnet.
10.3.2 Bindungsarten
In den Abschnitten über Metalleigenschaften und Atomgrößen haben wir festgestellt, dass typische Metall-Atome besonders groß sind, viele Elektronenschalen und nur wenig Elektronen in der äußersten Schale besitzen. Umgekehrt sind typische Nichtmetall-Atome besonders klein, haben wenige Elektronenschalen und viele Elektronen in der äußersten Schale.
Nach den Eigenschaften einer chemischen Bindung lassen sich grob drei grundlegende Arten für die Bindung von Atomen unterscheiden:
Bindung zwischen einem typischen Metall und einem typischen Nichtmetall (Ionenbindung)
Bindung zwischen zwei typischen Nichtmetallen (Kovalente Bindung)
Bindung zwischen zwei typischen Metallen (Metallbindung)
In der Natur gibt es auch Übergangsformen dieser Bindungen. Die einzelnen Bindungsarten und ihre Eigenschaften werden in den folgenden Abschnitten genauer besprochen.
10.3.3 Elektronegativität
Für jede chemische Bindung ist ausschließlich die elektrische Kraft zwischen den Atomen verantwortlich. Aus großer Entfernung betrachtet, sind Atome elektrisch neutral, da sie gleich viele positive wie negative Ladungsträger besitzen. In ihrer unmittelbaren Nähe spielt der konkrete Aufbau der Elektronenhülle jedoch eine wichtige Rolle. Sie entscheidet, wie stark die positive Kernladung nach außen hin abgeschirmt wird.
Kommen Atome einander sehr nahe und gehen eine Bindung ein, gibt es Elektronen (Bindungselektronen), die von beiden Atomen angezogen werden. Die Elektronegativität (engl. electronegativity) ist ein Maß für die Fähigkeit eines Atoms, Bindungselektronen an sich zu ziehen.
Anhand des Diagramms 10.21 kannst du folgende Tendenzen im Periodensystem erkennen:
- Innerhalb einer Periode von links nach rechts mit zunehmender Kernladungszahl steigt auch die Elektronegativität.
- Innerhalb einer Gruppe von oben nach unten sinkt die Elektronegativität, weil die Anzahl besetzter Hauptschalen zunimmt und dadurch die Kernladung immer besser abgeschirmt wird.
In einer chemischen Bindung von zwei Atomen gibt die Differenz der Elektronegativitäten darüber Auskunft, wo sich der Ladungsschwerpunkt – also die Lage der Bindungselektronen relativ zu den beiden Atomen – befindet. Wie stark der Ladungsschwerpunkt verschoben ist, entscheidet über die Eigenschaften der chemischen Bindung und damit auch, zu welcher Bindungsart sie zugeordnet wird. Hier eine grobe Einteilung:
- Eine Differenz kleiner als 0,5 führt zu unpolaren kovalenten Bindungen.
- Eine Differenz zwischen 0,5 bis 1,7 führt zu polar kovalenten Bindungen.
- Eine Differenz größer als 1,7 führt zu ionischen Bindungen.
10.3.4 Summenformel
Moleküle (abgeschlossene Atomverbände) werden üblicherweise durch ihre Summenformel (engl. molecular formula) angeschrieben. Aus ihr erkennst du die Art und Anzahl der Atome, die in dem Molekül vorhanden sind.
Die Summenformel besteht aus der (alphabetischen) Aneinanderreihung der chemischen Symbole der beinhalteten Atome. Sind gleiche Atome mehrmals enthalten, wird die Anzahl als herabgesetzte Zahl dahinter vermerkt. Hier einige Beispiele:
10.3.5 Kovalenten Bindung
Die Elektronenpaarbindung, kovalenten Bindung oder auch Atombindung oder Elektronenpaarbindung (engl. covalent bond) kommt zwischen zwei typischen Nicht-Metallen, die schon viele Elektronen in der Valenzschale besitzen, vor. Dabei rücken die Atome zusammen und teilen sich ein oder mehrere Elektronenpaare, um den Edelgaszustand – oder im Fall des Wasserstoffs – eine voll besetzte Schale zu erreichen. In Bild 10.22 siehst du die kovalente Bindung zwischen zwei Wasserstoff-Atomen.
Valenzelektronen (also die Elektronen der äußersten Schale) werden üblicherweise als Punkte und gemeinsame Elektronenpaare zwischen den Atomen als Strich dargestellt (siehe Abschnitt Strukturformel). In Bild 10.23 siehst du weitere Beispiele für kovalente Bindungen
Beispiel Sauerstoff-Molekül (\(\mathrm{O_2}\)): besitzt 6 Valenzelektronen. Teilen sich zwei Sauerstoff-Atome zwei Elektronenpaare, erreichen beide die Edelgaskonfiguration (). Weil sich die Atome gleich zwei Elektronenpaare teilen, wird diese Bindung Doppelbindung genannt.
Beispiel Wasser-Molekül (\(\mathrm{H_2O}\)): Einem Wasserstoff-Atom fehlt ein Elektron für eine voll besetzte Schale und dem Sauerstoff-Atom zwei Elektronen für die Edelgaskonfiguration. Daher teilt sich das Sauerstoff-Atom mit zwei Wasserstoff-Atomen je ein Elektronenpaar. Auf diese Weise entstehen zwei Einfachbindungen.
Beispiel Chlorwasserstoff-Molekül (\(\mathrm{HCl}\)): Chlor besitzt 7 Valenzelektronen, Wasserstoff eines. Teilen sich beide ein Elektronenpaar, erhält das Wasserstoff-Atom eine voll besetzte Schale und das Chloratom erreicht den Edelgaszustand.
Beispiel Kohlendioxid-Molekül (\(\mathrm{CO_2}\)): Ein Kohlenstoff-Atom besitzt nur 4 Valenzelektronen. Geht es mit zwei Sauerstoff-Atomen je zwei Doppelbindungen ein, erreicht es den Edelgaszustand, so wie auch die beiden verbundenen Sauerstoff-Atome.
Beispiel Stickstoff-Molekül (\(\mathrm{N_2}\)): Stickstoff fehlen 3 Elektronen zur Edelgaskonfiguration. Teilen sich zwei Stickstoff-Atome drei Elektronenpaare (Dreifachbindung) erreichen beide den Edelgaszustand.
Beispiel Stickstoffoxid-Molekül (\(\mathrm{NO}\)): Teilt sich der Sauerstoff mit dem Stickstoff zwei Elektronenpaare, erreicht der Sauerstoff die Edelgaskonfiguration. Der Stickstoff ist seinem Ziel, den Edelgaszustand zu erreichen, näher gekommen, aber es fehlt noch ein Elektron. Atome oder Moleküle mit mindestens einem ungepaarten Valenzelektron sind häufig besonders reaktionsfreudig. Sie werden Radikale genannt.
Bei der Atombindung entstehen üblicherweise abgeschlossene Atomverbände (Moleküle). In seltenen Fällen kommt es auch zu einem Atomgitter, wie bei Diamant (einem Gitter aus Kohlenstoffatomen) oder bei Siliciumcarbid (einem Gitter aus Kohlenstoff- und Siliziumatomen).
10.3.6 Bindungslänge
Bei der Bindung von Atomen zu Molekülen wirken elektrische Kräfte. Einzelne Atome sind prinzipiell elektrisch neutral. Sind sie einander jedoch sehr nahe, führt die gegenseitige Beeinflussung zu einer Ladungsverschiebung und es kommt zu anziehenden oder abstoßenden Kräften (Bild 10.24).
Je nach Abstand zwischen beiden Atomen kommt es zu unterschiedlich großen anziehenden und abstoßenden Kräften. In einem bestimmten – von beiden Bindungspartnern abhängigen Abstand – gibt es ein Kräfte-Gleichgewicht. Hier besitzt die potenzielle Energie ein Minimum (Bild 10.25).
Diese Entfernung ist die Bindungslänge, die bei gebundenen Molekülen gemessen wird. Für Wasserstoff beträgt dieser Abstand \(74\;\mathrm{pm}\) (Piko-Meter, billiardstel Meter, \(10^{12}\)) oder rund \(1{,}4\) Atomradien.
Der genaue Verlauf der potenziellen Energie unterscheidet sich zwar bei den einzelnen Bindungsarten und auch von Atom-Sorten zu Atom-Sorte, der prinzipielle Kurvenverlauf ist aber immer derselbe. In einer bestimmten Entfernung gibt es ein Energie-Minimum, und dort kommt es zu einem gebundenen Zustand.
10.3.7 Strukturformel
Die Strukturformel (engl. structural formula) beschreibt, wie Atome in einem Molekül verbunden und im Raum angeordnet sind und vermittelt ein genaueres Bild als die Summenformel. In Bild 10.26 siehst du als Beispiele die Strukturformeln von Wasser (\(\mathrm{H_2O}\)) und Methan (\(\mathrm{CH_4}\)).

Bild 10.26: Beispiele für Strukturformeln: (a) Elektronenformel, (b) Valenzstrichformel, (c) Keilstrichformel
Folgende Darstellungen sind üblich:
In der Elektronenformel sind die Valenzelektronen als Punkte gezeichnet (10.26 a).
In der Valenzstrichformel (10.26 b) stellen Striche zwischen den Atomen die Einfach- oder Mehrfachbindungen in einem Molekül dar. Valenzelektronen, die nicht zu einer Bindung beitragen, werden in dieser Darstellung nicht gezeichnet.
Die Keilstrichformel (10.26 c) deutet zusätzlich die räumliche Struktur an, indem keilförmig fett gezeichnete Bindungen aus der Zeichenebene heraus und keilförmig strichliert gezeichnete Bindungen in die Zeichenebene hinein zeigen. Zum Beispiel bilden die Wasserstoff-Atome in einem Methan-Molekül die Ecken eines Tetraeders.
10.3.8 Ionenbindung
Trifft ein typisches Metallatom (mit wenigen Valenzelektronen) und ein typisches Nicht-Metall (mit vielen Valenzelektronen) aufeinander, können beide Atome die Edelgaskonfiguration erreichen, wenn das Metall-Atom Elektronen an das Nicht-Metall abgibt. In Bild 10.27 siehst du das am Beispiel von Natrium (Metall, 1 Valenzelektron) und Chlor (Nicht-Metall, 7 Valenzelektronen).
Durch den Elektronentausch sind jetzt beide Atome nicht mehr elektrisch neutral.
Dem Natrium fehlt ein Elektron (ist jetzt einfach positiv geladen) und das Chloratom hat ein Elektron zu viel (ist einfach negativ geladen).
Die elektrostatische Kraft lässt die beiden entgegengesetzt geladenen Atome aneinander haften.
Es entsteht Natriumchlorid, besser bekannt als Kochsalz.
Da geladene Atome und Moleküle als Ionen bezeichnet werden, heißt diese Art der Bindung Ionenbindung (engl. ionic bonding).
Im Allgemeinen führt die Ionenbindung nicht zu einzelnen Molekülen, sondern zu regelmäßigen Kristallen (Bild 10.28). Sie werden als Salze oder salzartige Stoffe bezeichnet. Kristalle sind spröde und nicht verformbar. Wirkt eine zu große Kraft auf sie ein, verschieben sich die Ionen entlang einer Ebene. Nebeneinanderliegende gleichartige Ionen stoßen nebeneinander ab und der Kristall bricht an dieser Stelle (Bild 10.29).
Viele Salze lassen sich – wie Kochsalz – gut in Wasser lösen. In der Lösung können sich die Ionen jetzt frei bewegen. Gelöste Salze sind daher gute elektrische Leiter.
10.3.9 Atomare Dipole
In symmetrischen Molekülen, wie \(\mathrm{H_2}\), \(\mathrm{O_2}\) oder \(\mathrm{N_2}\), fallen die Ladungsschwerpunkte aller positiven und die Ladungsschwerpunkte aller negativen Ladungen zusammen. Damit sind diese Moleküle elektrisch neutral (unpolare kovalente Bindung).
Ist die Differenz der Elektronegativität der Bindungspartner groß, kann es sein, dass die Ladungen so ungleichmäßig verteilt sind, dass ein ausgeprägter elektrischer Dipol entsteht (polare kovalente Bindung). Ein bekanntes Beispiel dafür ist das Wassermolekül (Bild 10.30).
Der griechische Kleinbuchstabe Delta wird zur Kennzeichnung von geladenen Stellen verwendet: negative Teilladungen mit \(\delta^-\) („Delta Minus“) und positive mit \(\delta^+\) („Delta Plus“).
10.3.10 Van-der-Waals-Kräfte
Die positiven und negativen Stellen eines Atoms, die durch polare kovalente Bindung entstehen, üben Anziehungskräfte auf andere atomare Dipole aus.
Abgesehen davon kommt es auch zwischen polaren und unpolaren Molekülen, ja sogar zwischen zwei unpolaren Molekülen zu anziehenden Kräften. Die Elektronenschale ist kein starres Gebilde. Durch Schwingungen und auch durch die Nähe von Ladungen kommt es in ungeladenen, unpolaren Molekülen zu kurzzeitigen Ladungsverschiebungen und sie werden zu zeitlich begrenzten elektrischen Dipolen.
Diese relativ schwach anziehenden elektrischen Kräfte, die es praktisch zwischen allen Molekülen gibt, werden als Van-der-Waals-Kräfte (engl. van der waals force) bezeichnet, benannt nach seinem Entdecker Johannes Diderik van der Waals. Diese Dipol-Dipol-Kräfte zwischen Molekülen sind wesentlich schwächer als Elektronenpaar-, Ionen- oder Metallbindung zwischen Atomen, haben aber trotzdem makroskopische Auswirkungen auf die Stoffeigenschaften, wie zum Beispiel auf den Siedepunkt.
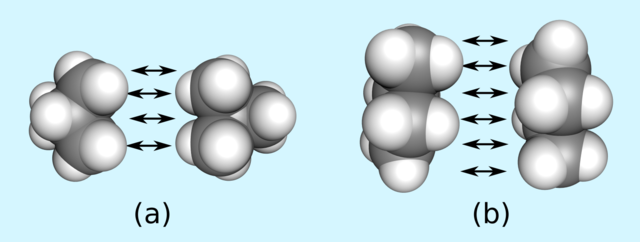
Zum Beispiel ist der Siedepunkt von n-Butan (Bild 10.31 rechts) höher als der von iso-Butan (Bild 10.31 links), obwohl beide Moleküle aus denselben Atomen bestehen. Der Unterschied lässt sich aber mit der unterschiedlichen Oberfläche beider Moleküle erklären. Je größer die Moleküloberfläche, desto mehr „Andockstellen“ gibt es und desto größer sind die Van-der-Waals-Kräfte.
Obwohl hier die Bindungskräfte wesentlich kleiner als in kovalenter, ionischer oder Metallbindung sind, gibt es sogar Festkörper, die ausschließlich durch Van-der-Waals-Kräfte zusammengehalten werden. Die nur bei tiefen Temperaturen vorkommenden Edelgaskristalle sind ein Beispiel dafür.
10.3.11 Metallbindung
Metalle erreichen ihre Edelgaskonfiguration, indem sie ihre wenigen Valenzelektronen abgeben. Die verbleibenden positiv geladenen Metallionen („Atomrümpfe“) müssten einander abstoßen. Die frei gewordenen Valenzelektronen bewegen sich aber zwischen den positiv geladenen Atomrümpfen („Elektronengas“) und sorgen für den Zusammenhalt (Bild 10.32). Dass diese Elektronen zu keinem bestimmten Atom mehr gehören, werden sie als delokalisiert bezeichnet.
Diese Bindung zwischen Metallen heißt Metallbindung (engl. metallic bonding).
Viele Metalle sind weich und verformbar. Wirkt eine ausreichend große Kraft auf das Metallstück, verschieben sich die Atomrümpfe im Elektronengas, aber die Struktur bleibt erhalten (Bild 10.33).
10.3.12 Organische Verbindungen
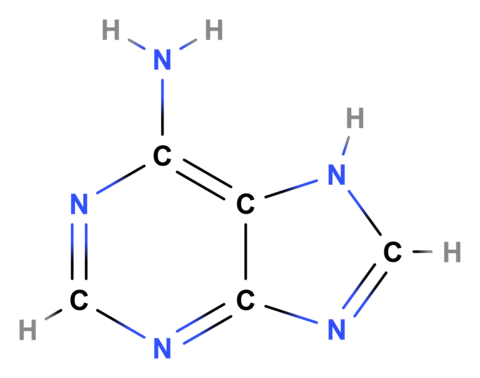
Aufgrund seiner besonderen Elektronenkonfiguration (halbgefüllte L-Schale) besitzt Kohlenstoff die Fähigkeit zur Bildung sehr komplexer Moleküle und weist von allen chemischen Elementen die größte Vielfalt an chemischen Verbindungen auf. Diese Eigenschaft macht Kohlenstoff und seine Verbindungen zur Grundlage des Lebens auf der Erde. In Bild 10.34 als Beispiel für eine Kohlenstoff-Verbindung Adenin, die Teil deines genetischen Codes ist.
Heute sind mehr als 40 Millionen Kohlenstoffverbindungen bekannt (organische Verbindung, engl. organic compound). Daher gibt es einen eigenen Zweig der Chemie, der sich ausschließlich mit Kohlenstoffverbindungen beschäftigt, die organische Chemie. Alle anderen Verbindungen zählen zu den anorganischen Verbindungen.
Der Name „organisch“ geht auf die frühere Fehlvorstellung zurück, dass sich bestimmte Verbindungen nicht künstlich herstellen lassen, sondern nur in Lebewesen (Organismen) entstehen. Als erste organische Verbindung wurde der Harnstoff künstlich hergestellt und damit die Annahme widerlegt.