14.4 Zustände von Materie und deren Änderung
In Bild 14.23 siehst du einen besonderen Eiswürfel: Er wird immer kleiner, schmilzt dabei aber nicht.
Bei dem Eiswürfel handelt es sich nicht um gefrorenes Wasser, sondern gefrorenes Kohlendioxyd – sogenanntes Trockeneis. Wieso Trockeneis nicht flüssig wird, welche grundlegenden Zustandsformen von Materie es gibt und wie sich ihr Zustand bei Temperatur (und Druck) ändern, erfährst du in diesem Kapitel.
14.4.1 Aggregatzustände
Je nach Umgebungsdruck und -temperatur nehmen Stoffe unterschiedliche Aggregatzustände (engl. states of matter) an. Es gibt drei klassische Aggregatzustände: fest, flüssig und gasförmig.
In einem Feststoff (engl. solid) befinden sich die Atome und Moleküle in einem festen Gitter. Sie bleiben an Ort und Stelle und können nur um ihre Ruhelage schwingen.
In einer Flüssigkeit (engl. Liquid) sind die Atome und Moleküle lose gebunden und können sich zueinander verschieben. Sie passen sich jeder Gefäßform an.
In einem Gas (engl. gas) bewegen sich die Atome und Moleküle frei durch den Raum. In einem geschlossenen Raum verteilen sie sich in kürzester Zeit gleichmäßig. Die Stöße mit den Gefäßwänden erzeugen den Druck des Gases.
14.4.2 Aggregatzustandsänderung
Die Wechsel von einem Aggregatzustand in einen anderen haben bestimmte Namen.
- Schmelzen: Bezeichnet den Übergang von fest zu flüssig.
- Erstarren: Bezeichnet den Übergang von flüssig zu fest.
- Verdampfung: Bezeichnet den Übergang von flüssig zu gasförmig.
- Kondensation: Bezeichnet den Übergang von gasförmig zu flüssig.
- Sublimation: Bezeichnet den Übergang von fest zu gasförmig. Das bekannteste Beispiel ist Trockeneis. Festes Kohlenstoffdioxid (\(\mathrm{CO}_2\)) geht bei Zimmertemperatur und Normaldruck sofort in den gasförmigen Zustand über, ohne jemals flüssig zu sein.
- Resublimation: Bezeichnet den Übergang von gasförmig zu fest.
Das folgende Diagramm 14.27 fasst die Übergänge noch einmal zusammen.
14.4.3 Plasma
Wird ein Gas immer weiter erwärmt, kommt es schließlich zu einem vierten Aggregatzustand: dem Plasma (engl. plasma). Bei dieser Zustandsform ist die thermische Bewegung der Teilchen so groß, dass Atome in ihre Bausteine zerfallen – zuerst lösen sich die Elektronen von den Kernen und bei noch höheren Temperaturen zerfallen sogar die Kerne. Das Plasma in Bild 14.28 hat eine Temperatur von unglaublichen 23 Millionen Grad Celsius!

Bild 14.28: Plasma in einem Fusionsreaktor.
Der Übergang von einem Gas zu einem Plasma wird als Ionisation bezeichnet. Die Umkehrung, also der Übergang eines Plasmas zu einem Gas als Rekombination.
14.4.4 Phase
Die Begriffe Aggregatzustand und Phase werden oft synonym verwendet. Eis zum Beispiel wird oft als die „fest Phase von Wasser“ bezeichnet. Trotzdem besteht ein Unterschied zwischen beiden Begriffen!
Als Phase (engl. phase) wird ein Bereich gleicher physikalischer Eigenschaften (wie etwa Dichte oder elektrische Leitfähigkeit) bezeichnet.
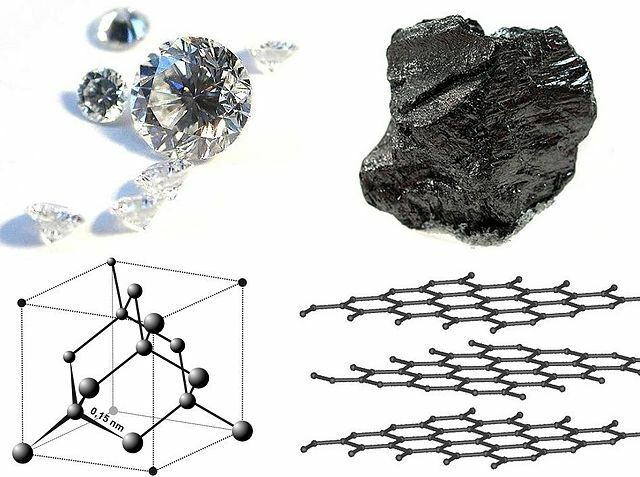
Manche Stoffe besitzen mehrere feste Phasen mit unterschiedlicher Gitterstruktur. Das bekannteste Beispiel ist Kohlenstoff, der in den festen Phasen Graphit und Diamant vorkommt (Bild 14.29).
14.4.5 Phasendiagramme
Der Zusammenhang zwischen Druck, Temperatur und Phase (Aggregatzustand) kann in einem Phasendiagramm (engl. phase diagram) zusammengefasst werden (Bild 14.30).
Im Phasendiagramm kannst du zwei besondere Punkte erkennen:
Tripelpunkt: Bei dieser Temperatur und bei diesem Druck können alle 3 Aggregatzustände gleichzeitig existieren.
kritischer Punkt: Jenseits dieses Punktes kann ein Gas nicht mehr verflüssigt oder verfestigt werden. Ist die Temperatur größer als die kritische Temperatur, kann es keinen flüssigen Aggregatzustand geben, egal, wie groß der Druck wird.
Die Kurven in dem Phasendiagramm werden Phasengrenzlinien genannt:
Die Siede- oder Kondensationskurve befindet sich zwischen Tripelpunkt und dem kritischen Punkt. Sie trennt die flüssige und die gasförmige Phase.
Die Sublimations- oder Resublimationskurve befindet sich zwischen Tripelpunkt und Ursprung. Sie trennt die feste und die gasförmige Phase.
Die Schmelz- oder Erstarrungskurve trennt die feste und die flüssige Phase.
Sieh dir die Siedekurve zwischen den Bereichen flüssig und gasförmig an. Wird der Druck kleiner, sinkt die Siedetemperatur. Das hat zum Beispiel eine Auswirkung auf das Kochen von Wasser. Während Wasser auf Meereshöhe bei \(100^\circ\mathrm{C}\) siedet, ist der Luftdruck auf der Spitze des Mount Everest so klein, dass Wasser schon bei rund \(70^\circ\mathrm{C}\) zu kochen beginnt. Willst du im Gegenteil den Siedepunkt erhöhen, um etwa die Kochzeit von Kartoffeln zu verkürzen, kannst du einen Druckkochtopf verwenden. Innerhalb des Kochtopfs steigt der Druck auf rund \(1{,}8\;\mathrm{bar}\). Das Kochwasser siedet dann erst bei einer Temperatur von \(117^\circ\mathrm{C}\).
14.4.6 Anomalie des Wassers
Das Phasendiagramm von Wasser (Bild 14.31) unterscheidet sich von dem Phasendiagramm eines normalen Stoffes.
Die Schmelzkurve von Wasser hat eine negative Steigung. Sie führt bei steigendem Druck hin zu niedrigeren Temperaturen. Das äußert sich zum Beispiel dadurch, dass die Dichte von Eis (feste Phase) kleiner ist als die Dichte von flüssigem Wasser. Eis schwimmt somit auf Wasser. Die Eigenschaft, dass die Dichte bei Druck geringer wird, heißt Dichteanomalie. Außer Wasser gibt es noch weitere Stoffe, die eine solche Anomalie zeigen.
Neben der Dichteanomalie zeigt Wasser noch eine weitere wichtige Besonderheit (Bild 14.32). Die größte Dichte besitzt flüssiges Wasser bei \(+4^{\circ}\;\mathrm{C}\) (und nicht bei \(0^{\circ}\;\mathrm{C}\)). Friert im Winter ein See zu, schichten sich die Bereiche unterschiedlicher Temperatur wie in Bild 14.33. Das wirkt einem vollständigen Durchfrieren des Gewässers entgegen und Wassertiere und -pflanzen können unter der Eisschicht überleben.