12.7 Batterie und Brennstoffzelle
In Bild 12.64 siehst du eines der bekanntesten Monster der Literatur.
Ziemlich schauriger Einstieg in dieses Kapitel! Luigi Galvani entdeckte die Muskelkontraktionen durch elektrischen Strom. Seine Experimente führten nicht nur zur Entwicklung der ersten Batterie, sondern inspirierten auch Mary Shelley zu ihrem Roman „Frankenstein“ (Originalausgabe).
Vor der Entwicklung der ersten Batterie waren die einzigen möglichen Geräte zur Erzeugung einer elektrischen Spannung Elektrisiermaschinen und Influenzmaschinen. Bis dahin war Elektrizität ein interessanter Zeitvertreib, aber es gab keine praktischen Anwendungen. Erst die Batterie gestattete es, eine konstante Spannung über einen längeren Zeitraum zu erzeugen.
In diesem Kapitel geht es um Geräte, die chemische Energie – also die Energie, die in chemischen Bindungen steckt, – in elektrische Energie umwandeln.
12.7.1 Galvanische Zelle
Als Galvanische Zelle wird eine Gleichspannungsquelle bezeichnet, die aus einem Elektrolyten und zwei unterschiedlichen Metallen (etwa Zink und Kupfer) besteht (Bild 12.65).
Positive Metallionen werden aus den beiden Metallen herausgelöst und Elektronen bleiben zurück. Allerdings werden beim „unedleren“ Metall (hier Zink) pro Sekunde mehr positive Ionen im Elektrolyten gelöst, als bei dem „edleren“ Metall (hier Kupfer). Daher bleiben im unedleren Metall mehr ungebundene Elektronen als im edleren Metall zurück und zwischen beiden Platten entsteht eine elektrische Spannung (Potenzialdifferenz). Werden Minuspol (Zink) und Pluspol (Kupfer) leitend verbunden, kann ein Strom fließen. Beachte: Der Pluspol der Batterie ist sehr wohl negativ geladen! Das Plus soll hier verdeutlichen, dass diese Elektrode weniger negativ geladen ist als die andere.
Die Bezeichnungen „edel“ und „unedel“ beziehen sich nicht darauf, wie wertvoll ein Metall ist, sondern wie stark sein Bestreben ist, positive Ionen in einer Säure abzugeben. Je unedler ein Metall, desto leichter gibt es positive Ionen ab.
12.7.2 Elektrochemische Spannungsreihe
Werden zwei unterschiedliche Metalle in einen Elektrolyten getaucht, kann eine für die jeweilige Metall-Kombination charakteristische Spannung gemessen werden. Zum Glück ist es nicht notwendig, die Spannung für alle möglichen Metall-Kombinationen zu notieren. Es genügt, die Spannung zwischen einem Metall und einer Standard-Wasserstoffelektrode – sie wurde willkürlich festgelegt – zu bestimmen. Diese Werte sind in der elektrochemischen Spannungsreihe (engl. galvanic series) festgehalten. Um die Spannung einer galvanischen Zelle mit zwei bestimmten Metallen zu erhalten, muss nur die Differenz der beiden Werte aus der elektrochemischen Spannungsreihe gebildet werden. Dabei musst du das Vorzeichen mit berücksichtigen!
In Bild 12.66 siehst du ein Beispiel für eine galvanische Zelle – eine Obstbatterie. Die Fruchtsäure des Apfels bildet den Elektrolyten, die positive Elektrode besteht aus einer Kupfer-Münze und die negative Elektrode aus einer Stahl-Schraube. Schlägst du die Werte für Kupfer (\(\mathrm{Cu}\)) und Eisen (\(\mathrm{Fe}\)) in der Tabelle der elektrochemischen Spannungsreihe nach, erhältst du:
\[ U_{\mathrm{Cu}-\mathrm{Fe}}=+0{,}52\;\mathrm{V}-(-0{,}41\;\mathrm{V})=0{,}93\;\mathrm{V} \]
Unsere Obstbatterie erzeugt also eine Spannung von rund \(0{,}9\;\mathrm{V}\).
12.7.3 Kapazität einer Batterie
Als Kapazität einer Batterie (engl. battery capacity) wird jene Ladungsmenge bezeichnet, die durch die chemischen Prozesse einer Batterie insgesamt getrennt werden kann. Meist wird diese Ladungsmenge allerdings nicht in der Ladungseinheit Coulomb (\(\mathrm{C}\)) angegeben, sondern in der Einheit Amperestunden (\(\mathrm{Ah}\)). Eine Amperestunde ist die Ladungsmenge, die bei einer Stromstärke von \(1\;\mathrm{A}\) innerhalb einer Stunde durch den Leiterquerschnitt fließt.
\[\begin{equation} 1\;\mathrm{Ah} = 3600\;\mathrm{As} = 3600\;\mathrm{C} \tag{12.24} \end{equation}\]
Die Kapazität von kleinen Batterien wird in Milliamperestunden (\(\mathrm{mAh}\)) angegeben, also in tausendstel Amperestunden.
12.7.4 Batterien in Serienschaltung
Werden mehrere Spannungsquellen hintereinander geschaltet, so bilden sie eine Serienschaltung. Dabei werden jeweils Plus- und Minuspol verbunden und jede weitere Spannungsquelle erhöht die elektrische Potenzialdifferenz. Die Gesamtpotenzialdifferenz (Gesamtspannung) ist die Summe aller Einzelspannungen.
Bezeichnen wir die Einzelspannungen mit \(U_1\), \(U_2\),… \(U_n\) (Bild 12.67), dann ist die Gesamtspannung \(U_\mathrm{ges}\):
| \[\begin{equation} U_\mathrm{ges} = U_1 + U_2 + \ldots + U_n \tag{12.25} \end{equation}\] |
Willst du zum Beispiel eine Spannung von \(3\;\mathrm{V}\) erhalten, kannst du zwei \(1{,}5\;\mathrm{V}\)-Batterien in Serie schalten, wie bei der Fernbedienung in Bild 12.68.
12.7.5 Batterien in Parallelschaltung
Werden \(n\) Batterien gleicher Spannung parallel verbunden (Bild 12.69), entspricht die Gesamtspannung genau dieser Spannung der einzelnen Batterien. Durch die Parallelschaltung von Batterien gleicher Spannung addieren sich aber ihre Kapazitäten. Entsprechend länger dauert es, bis die einzelnen Batterien leer sind.
Verbindest du vier \(12\;\mathrm{V}\) mit einer Kapazität von \(100\;\mathrm{Ah}\) in einer Parallelschaltung, erhältst du eine Spannungsquelle mit \(12\;\mathrm{V}\) und einer Kapazität von \(400\;\mathrm{Ah}\).
Die Parallelschaltung von Batterien unterschiedlicher Spannungen ist nicht sinnvoll! Hier würde ein Ausgleichsstrom zwischen den Batterien zu einer rascheren Entleerung der Batterien führen. In Anleitungen von Geräten mit parallel geschalteten Batterien findet sich oft ein Hinweis, dass nur gleiche Batterien verwendet werden sollen. Grund dafür ist, dass nicht nur die Spannung der Batterien, sondern auch ihr Innenwiderstand gleich sein sollte. Der kann sich von Hersteller zu Hersteller aber unterscheiden.
12.7.6 Kombination von Serien- und Parallelschaltung von Batterien
Durch die Kombination aus Serien- und Parallelschaltung von gleichen Batterien lässt sich eine Gleichspannungsquelle aufbauen, die eine gewünschte Spannung und Kapazität besitzt. Durch die Parallelschaltung lässt sich die Gesamtkapazität erhöhen und durch die Serienschaltung die gewünschte Höhe der Spannung.
Die Kombination von Akkus in Bild 12.70 mit je einer Spannung von \(3{,}25\;\mathrm{V}\) und einer Kapazität von je \(400\;\mathrm{Ah}\) ergibt einen Batteriespeicher mit einer Spannung von \(52\;\mathrm{V}\) und einer Kapazität von \(800\;\mathrm{Ah}\).
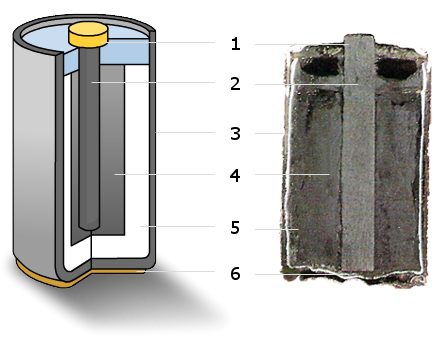
12.7.7 Trockenbatterien
Die meisten Batterien, die heute hergestellt werden, sind Alkali-Mangan-Zellen und verwenden eine feuchte Paste als Elektrolyt (daher die Bezeichnung „Trockenbatterie“). Eine Trockenbatterie lässt sich in jeder Lage verwenden, ohne dass die Gefahr des Auslaufens besteht.
In Bild 12.71 siehst du den Aufbau einer modernen Batterie:
- Metallkappe (Pluspol)
- Kohlenstoffstab (positive Elektrode)
- Zinkgehäuse (negative Elektrode)
- Mangan(IV)-Oxid (verbessert Funktion und Lebensdauer)
- feuchte Paste aus Ammoniumchlorid (Elektrolyt)
- Metallboden (Minuspol)
Alkali-Mangan-Zellen liefern eine Spannung von \(1{,}5\;\mathrm{V}\). In Bild 12.72 siehst du einige gebräuchliche Batterieformen und ihre Bezeichnungen.
Fast alle Batterien haben eine Spannung von \(1{,}5\;\mathrm{V}\). Die Flachbatterie (\(4{,}5\;\mathrm{V}\)) und die Block-Batterie (\(9\;\mathrm{V}\)) haben Spannungen, die Vielfache von \(1{,}5\;\mathrm{V}\) sind, da intern mehrere 1,5V-Zellen in Serie geschaltet sind (Bild 12.73).
Alte Batterien quellen oft auf und sondern eine Flüssigkeit ab. Diese austretende Flüssigkeit ist der Elektrolyt. Durch den Gebrauch der Batterie wird das Zink im Gehäuse der negativen Elektrode abgebaut. Bei langer Kontaktzeit zersetzt der Elektrolyt das Zinkgehäuse so weit, dass es löchrig wird und die Batterie „ausläuft“. Um Geräte, die du längere Zeit nicht verwendest, vor Schaden zu bewahren, solltest du daher die Batterien entfernen und separat lagern.
12.7.9 Brennstoffzelle
Im Gegensatz zu einer Batterie wird in einer Brennstoffzelle kontinuierlich Brennstoff (zum Beispiel Wasserstoff) zugeführt und durch eine kontrollierte Verbrennung (Oxidation) direkt in elektrische Energie umgewandelt. Dadurch wird der Umweg über die Erwärmung eines Arbeitsmittels wie bei Wärmekraftmaschinen vermieden. Der Wirkungsgrad ist bei der „kalten Verbrennung“ in einer Brennstoffzelle dadurch zwar höher (bis zu 60 Prozent) als der Wirkungsgrad einer Wärmekraftmaschine, allerdings ist auch der Aufwand zur Herstellung und Lagerung des Brennstoffes bei einer Brennstoffzelle höher.
Wir zeigen die Funktion einer Brennstoffzelle beispielhaft an der Polymerelektrolytbrennstoffzelle. Sie verwendet als Brennstoff Wasserstoff, der mit Sauerstoff aus der Umgebungsluft zu Wasser verbrannt wird. Eine Zelle liefert dabei eine Spannung von rund \(1\;\mathrm{V}\) bei einer Betriebstemperatur von rund \(60\;^\circ\mathrm{C}\).
In Bild 12.75 siehst du den vereinfachten Aufbau dieser Brennstoffzelle. Trifft Wasserstoff auf das Anodenmaterial, werden die Wasserstoffatome in Protonen (\(\mathrm{H^{+}}\)) und Elektronen (\(\mathrm{e^{-}}\)) zerlegt.
\[ \mathrm{2\ H_{2}\to 4\ H^{+}+4\ e^{-}} \]
Das geschieht deshalb, weil die Elektrodenmaterialien (meistens Edelmetalle) als Katalysator wirken. Die Elektronenkonzentration an der Anode steigt und es entsteht eine Potenzialdifferenz (elektrische Spannung) zwischen beiden Elektroden. Sind Anode und Kathode leitend verbunden, fließt elektrischer Strom und die Elektronen wandern über den Verbraucher zur Kathode.
Die Membran zwischen den Elektroden (engl. Proton Exchange Membrane, PEM) lässt nur Protonen passieren. An der Kathode treffen die als elektrischer Strom gewanderten Elektronen und die Protonen aus der Membran auf den Sauerstoff und werden zu dem „Abfallprodukt“ Wasser (\(\mathrm{H_2O}\)) reduziert.
\[ \mathrm{O_2 + 4\ H^+ + 4\ e^- \to 2\ H_2O} \]
Als Gesamtreaktion erhältst du:
\[\begin{equation} \mathrm{2\ H_{2}+O_{2}\to 2\ H_{2}O} \tag{12.26} \end{equation}\]
Neben unterschiedlichen Wasserstoff-Brennstoffzellen gibt es weitere Konstruktionen, die auch viele andere Brennstoffe verwenden können, zum Beispiel Methanol (Bild 12.76), Butan oder Erdgas.
12.7.10 Elektrizität im Tier- und Pflanzenreich
Viele Vorgänge in unserem Körper erzeugen schwache elektromagnetische Felder, die mit sehr empfindlichen Geräten gemessen werden können. Die bekanntesten davon sind das Elektroenzephalogramm (EEG) zur Messung elektrochemischer Signalübertragung in Gehirnzellen und das Elektrokardiogramm (EKG) zur Aufzeichnung der elektrischen Aktivität des Herzmuskels. Alle elektromagnetischen Phänomene, die mit Zellen von Lebewesen verbunden sind, werden allgemein als Bioelektrizität (engl. bioelectricity) bezeichnet.
Einige Tiere haben darüber hinaus spezielle Organe zur Erzeugung (engl. electrogenesis) und Wahrnehmung (engl. electroreception) elektrischer Felder entwickelt, die sie zur Orientierung und Kommunikation einsetzen. Da Wasser die Elektrizität viel besser leitet als Luft, handelt es sich dabei fast ausschließlich um Wasser- oder Amphibientiere. Die Ortung von Beutetieren erfolgt entweder passiv oder aktiv. Bei der passiven Ortung werden die elektrischen Felder wahrgenommen, die andere Lebewesen durch Herzschlag oder Muskelbewegungen erzeugen. Bei der aktiven Ortung erzeugen die Tiere selbst ein schwaches elektrisches Feld. Befindet sich ein nichtleitendes Objekt in seiner Nähe, wird das Feld wie bei einem Dielektrikum in einem Kondensator verändert. So kann es zwischen leitenden und nichtleitenden Objekten in seiner Nähe unterscheiden (Bild 12.77).

Bild 12.77: Die Elektrorezeptoren im Kopfbereich von Haien werden Lorenzinische Ampullen genannt.
Einige wenige Fische wie Zitteraale, Zitterrochen oder Zitterwelse besitzen ein Organ, das wie ein geladener Kondensator funktioniert. Damit können sie so starke elektrische Entladungen erzeugen, dass sie Angreifer oder Beutetiere in ihrer Umgebung betäuben oder sogar töten können.
Im Reich der Insekten dürfte Elektrizität ebenfalls eine wichtige Rolle spielen. Zum Beispiel kommt es beim Flügelschlag zu Reibung zwischen Luft und Flügel. Durch Reibungselektrizität laden sich die Körper von Fluginsekten elektrisch positiv auf. Experimente zeigen, dass Bienen dadurch elektrostatische Felder in der Umgebung von Blumen wahrnehmen können. Ihre elektrostatische Ladung ermöglicht ihnen sogar, Pollen über einen Luftspalt hinweg zu sammeln (12.78).
Im Spätsommer kommt es zum „Altweibersommer“. Dabei erzeugen Spinnen lange Fäden, mit deren Hilfe sie durch die Luft getragen werden. Auch wenn die englische Bezeichnung für dieses Phänomen ballooning ist: Der Auftrieb entsteht nicht wie bei einem Ballon durch statischen Auftrieb, sondern durch die elektrische Kraft. Bei der Produktion der Spinnenseide wird der Faden negativ geladen und die Kraft im elektrischen Feld der Atmosphäre hebt den Faden samt der Spinne empor. Sollten Spinnen ihre Netze generell negativ laden, würden positiv geladene Fluginsekten sogar von Spinnennetzen aktiv angezogen.
Links: